PH فاز متحرک میتواند ابزاری قدرتمند برای کنترل ماندگاری و انتخابپذیری باشد، اما اگر به درستی کنترل نشود، میتواند شما را با مشکل مواجه کند. تنظیم pH فاز متحرک میتواند ابزار قدرتمندی برای به دست آوردن جداسازیهای کروماتوگرافی مایع (LC) باشد، اما در عین حال، کنترل ضعیف pH میتواند منبع مشکلات جدی در جداسازی باشد. در این قسمت از «عیبیابی LC» میخواهم روی pH فاز موبایل و نقش آن در Retention و Selectivity تمرکز کنم.
بازگشت به مبانی: نقش pH در Retention و Selectivity
بازگشت به مبانی: نقش pH در Retention و Selectivity
pH و Retention
در LC فاز معکوس، Retention یا بازداری آنالیت ها تحت تاثیرماهیت کلی آبگریز یا غیرقطبی بودن آنالیت ها است. ترکیباتی که قطبی تر هستند نسبت به همتایان غیرقطبی خود زمان ماند کوتاه تری دارند. در نتیجه، ترتیب شستشوی کروماتوگرام معمولی از سمت ترکیبات قطبی به غیرقطبی می باشد. اگر تمام اجزای نمونه خنثی باشند، pH فاز متحرک به طور کلی می تواند به عنوان یک عامل مهم در بازداری نادیده گرفته شود. این وضعیت در کروماتوگرام های شکل 1 مشاهده می شود، جایی که پیک های بدون نام و شویش شده (Eluted) بین 3 تا 9 دقیقه، ترکیبات خنثی هستند. توجه داشته باشید که بازداری ترکیبات خنثی با تغییر pH از 0/7 (شکل a1) به 0/3 (شکل b 1) تغییر نمی کند.
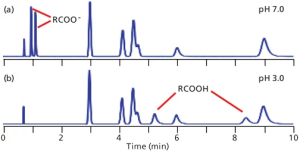 شکل 1: کروماتوگرام های شبیه سازی شده برای مخلوطی از شش ترکیب خنثی (پیک های بدون نام بین تقریباً 3 تا 9 دقیقه) و دو اسید کربوکسیلیک در (a) pH 7.0 و (b) pH 3.0. پیک در حدود 75/0 دقیقه t0 است.
شکل 1: کروماتوگرام های شبیه سازی شده برای مخلوطی از شش ترکیب خنثی (پیک های بدون نام بین تقریباً 3 تا 9 دقیقه) و دو اسید کربوکسیلیک در (a) pH 7.0 و (b) pH 3.0. پیک در حدود 75/0 دقیقه t0 است.
اگر آنالیتهای قابل یونیزاسیون وجود داشته باشند، هنگامی که pH فاز متحرک تغییر کند، تغییرات چشمگیری در Retention رخ میدهد. در شکل a1، اجزای کربوکسیلیک اسید به شدت در 0/7 pH یونیزه می شوند، بنابراین بار منفی، آنها را قطبی تر از مولکول های مشابه در 0/3 pH می نماید (شکل b1). بنابراین مشاهده می کنیم که pH می تواند تأثیر قابل توجهی بر حفظ ترکیبات یونیزاسیون داشته باشد.
در مثال فعلی، این موضوع نمایش داده می شود که بین PH 0/7 و 0/3 ، زمانهای ماند اسیدها بین شکلهای a1 و b1 قرار میگیرد.
بازداری اسید ها و باز ها:
جای تعجب نیست که تغییرات Retention اسیدها و بازها با تغییر در pH، در جهت مخالف است، همانطور که در شکل 2 نشان داده شده است. در شکل a2 ، ما میتوانیم مشاهده کنیم که اسیدها Retention خوبی در pH های پایین دارند و برعکس در pH های بالا Retention ضعیفی دارند. درست همانطور که در شکل 1 مشاهده می کنیم. دقیقا برعکس این موضوع برای بازها اتفاق می افتد. (شکل b2)، زیرا در PH بالا، بازها خنثی هستند و به خوبی حفظ(Retained) می شوند، در حالی که در pH پایین یونیزه می شوند و ضعیف حفظ(Retained) می شوند.
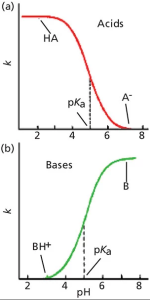 شکل 2: نمودارهای تعمیم یافته بازداری در مقابل pH فاز متحرک برای (a) نمونه های اسیدی و (b) نمونه های بازی. این نمودارها مستقیماً با هیچ یک از کروماتوگرامهای نمونه مطابقت ندارند، بلکه رفتار Retention کلی اسیدها و بازها را با تغییر pH نشان میدهند.
شکل 2: نمودارهای تعمیم یافته بازداری در مقابل pH فاز متحرک برای (a) نمونه های اسیدی و (b) نمونه های بازی. این نمودارها مستقیماً با هیچ یک از کروماتوگرامهای نمونه مطابقت ندارند، بلکه رفتار Retention کلی اسیدها و بازها را با تغییر pH نشان میدهند.
در نقطه میانی این منحنی ها pKa اسید یا باز قرار دارد که نیمی از مولکول های موجود یونیزه شده و نیمی دیگر یونیزه نیستند. توجه داشته باشید که اگرچه هر دو گونه یونیزه و غیریونیزه در pKa وجود دارند، تنها یک پیک مشاهده می شود. این به این دلیل اتفاق میافتد که تعادل بین این دو شکل در مقایسه با زمان عبور نمونه از ستون آنقدر سریع است که آنالیت از نظر کروماتوگرافی مانند میانگین مولکولهای موجود رفتار میکند. همانطور که pH برای اسیدها به pH پایین تر میل می کند، تعداد کل مولکول های موجود به شکل غیریونیزه شده افزایش می یابد و تعداد مولکول های یونیزه کاهش می یابد، بنابراین قطبیت کلی اسید کاهش می یابد و در نتیجه زمان ماند طولانی تر می شود. (حرکت به سمت چپ در شکل a2). بازها به تغییر pH واکنش مخالف دارند.
اگرچه تغییر در یونیزاسیون در حدود 1 واحد pH از pKa قابل توجه است، می توانید ببینید که منحنی ها در هر دو انتها تا جایی که pH 2 واحد pH یا بیشتر بالاتر یا پایین تر از pKa است صاف می شوند. به طور کلی در نظر گرفته می شود که در 2 واحد pH از pKa، یک اسید یا باز به طور کامل یونیزه می شود یا یونیزاسیون کاملاً سرکوب می شود. بنابراین تأثیر تغییر در pH فاز متحرک، به مقدار pH ، در مقایسه با pKa یک ترکیب بستگی دارد. این بدان معنی است که اگر بخواهیم از pH برای تنظیم Retention استفاده کنیم، این کار در حدود 1- 5/ 1 واحد pH از pKa بیشترین تأثیر را خواهد داشت. از سوی دیگر، برای قوی ترین شرایط Retention، pH فاز متحرک باید بیش از 5/1 واحد pH از pKa ترکیب باشد.
قدرت گزینش پذیری pH
زیبایی واقعی مطالعه pH فاز متحرک، در طول توسعه روش برای نمونههایی که حاوی اسیدها یا بازها هستند این می باشد که منحنی پاسخ pH در مقابل Retention تا حدودی از یک ترکیب به ترکیب دیگر متفاوت است، به خصوص اگر مقادیر pKa آنها متفاوت باشد. از نظر عملی، این بدان معنی است که تغییرات قابل توجهی در Retention و فاصله پیک را می توان با تغییر در pH فاز متحرک به دست آورد. نمونه ای از این موضوع، که در شکل b2 نشان داده شد، در شکل 3 برای جداسازی چهار آنیلین نشان داده شده است. پیکهای شکل a3 شمارهگذاری شدهاند و برای ردیابی راحتتر پیکها شکل 3 رنگی نشان داده شده اند. هویت آنالیت و مقادیر pKa برای پیک های شکل 3 در جدول I خلاصه شده است. توجه داشته باشید که مقادیر pKa برای این ترکیبات از 66/2 تا 98/3 متفاوت است. بحث بالا نشان داد که مقادیر pH در 5/1 ± واحد pH از pKa در تغییر Retention مؤثرتر خواهد بود، بنابراین ما انتظار داریم بیشترین حرکت را در محدوده pH 1/1 تا 5/5 ببینیم. من کروماتوگرام های شبیه سازی شده را در شکل 3 از 2 ≤ ≤ pH5/5 نشان داده ام. 2 pH < ممکن است باعث آسیب ستون شود و 5/5pH > تقریباً هیچ تغییری را نسبت به خود 5/5 pH ، برای این آنالیت ها نشان نمی دهد.
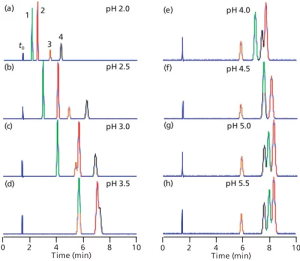 شکل 3: کروماتوگرام های شبیه سازی شده برای چهار آنیلین در مقادیر pH در شکل نشان داده شده است. داده های جدول I از (مرجع 1)، اما برای اندازه ستون 150 میلی متر در 6/4 میلی متر تنظیم شده است. نوع ستون: ستون StableBond CN (Agilent); فاز متحرک: 25:75 بافر – متانول. بافر: 25 میلی مولار سیترات سدیم (pH ≥ 4.0) یا فسفات پتاسیم (pH < 4.0). سرعت جریان: 1 میلی لیتر در دقیقه؛ دما: 35 درجه سانتی گراد . برای شناسایی ترکیبات و مقادیر pKa (2) به جدول I مراجعه کنید. اوج در 7/1~ دقیقه، t0 می باشد.
شکل 3: کروماتوگرام های شبیه سازی شده برای چهار آنیلین در مقادیر pH در شکل نشان داده شده است. داده های جدول I از (مرجع 1)، اما برای اندازه ستون 150 میلی متر در 6/4 میلی متر تنظیم شده است. نوع ستون: ستون StableBond CN (Agilent); فاز متحرک: 25:75 بافر – متانول. بافر: 25 میلی مولار سیترات سدیم (pH ≥ 4.0) یا فسفات پتاسیم (pH < 4.0). سرعت جریان: 1 میلی لیتر در دقیقه؛ دما: 35 درجه سانتی گراد . برای شناسایی ترکیبات و مقادیر pKa (2) به جدول I مراجعه کنید. اوج در 7/1~ دقیقه، t0 می باشد.
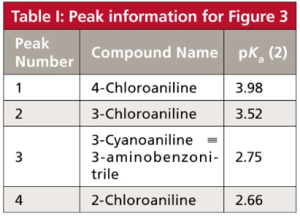 بیایید حرکت پیک های مختلف را ردیابی کنیم و ببینیم که آنها چگونه تحت تأثیر pH قرار می گیرند. پیک 4 (سیاه) با 66/2pKa = در 0/2pH یونیزه می شود، بنابراین کمترین مقدار ماند در این pH است. همانطور که PH به بالاتر از 5/2pH افزایش می یابد، گونه های غیریونیزه غالب می شوند و همانطور که انتظار می رود ماند افزایش می یابد. با رسیدن به pH 0/4، ~ 5/1 واحد pH بالاتر از pKa، یونیزاسیون سرکوب می شود (منطقه مسطح سمت راست شکل b2)، و در pH 0/4 – 5/5 تغییر کمی در ماند بوجود می آید . قله 3 (نارنجی) دارای pKa مشابه (75/2) است، بنابراین رفتار بسیار مشابه برای پیک های 3 و 4، با حفظ پایدار بالای 0/4 pH دیده می شود. اگرچه زمان ماند این دو پیک با pH تغییر می کند، انتخاب پذیری α، تنها مقدار کمی تغییر می کند (محدوده α = 1.36-1.40)، بنابراین آنها به خوبی در تمام مقادیر pH از هم جدا می شوند. (به یاد بیاورید که α نسبت فاکتورهای ماند(Retention Factors) ، k، برای دو قله مجاور است وقتیکه α = k4/k3.)
بیایید حرکت پیک های مختلف را ردیابی کنیم و ببینیم که آنها چگونه تحت تأثیر pH قرار می گیرند. پیک 4 (سیاه) با 66/2pKa = در 0/2pH یونیزه می شود، بنابراین کمترین مقدار ماند در این pH است. همانطور که PH به بالاتر از 5/2pH افزایش می یابد، گونه های غیریونیزه غالب می شوند و همانطور که انتظار می رود ماند افزایش می یابد. با رسیدن به pH 0/4، ~ 5/1 واحد pH بالاتر از pKa، یونیزاسیون سرکوب می شود (منطقه مسطح سمت راست شکل b2)، و در pH 0/4 – 5/5 تغییر کمی در ماند بوجود می آید . قله 3 (نارنجی) دارای pKa مشابه (75/2) است، بنابراین رفتار بسیار مشابه برای پیک های 3 و 4، با حفظ پایدار بالای 0/4 pH دیده می شود. اگرچه زمان ماند این دو پیک با pH تغییر می کند، انتخاب پذیری α، تنها مقدار کمی تغییر می کند (محدوده α = 1.36-1.40)، بنابراین آنها به خوبی در تمام مقادیر pH از هم جدا می شوند. (به یاد بیاورید که α نسبت فاکتورهای ماند(Retention Factors) ، k، برای دو قله مجاور است وقتیکه α = k4/k3.)
به طور مشابه می توانیم پیک 1 (سبز، 98/3 pKa =) و پیک 2 (قرمز، 52/3 pKa =) را دنبال کنیم. این پیکها همچنین با افزایش pH و کاهش یونیزاسیون به زمانهای ماند بالاتری میروند. با این حال، از آنجایی که مقادیر pKa برای پیکهای 1 و 2 تقریباً 1 واحد pH بیشتر از پیکهای 3 و 4 است، زمانهای ماند تا زمانی که تقریباً 1 واحد pH بالاتر باشند و همچنین در 0/5 pH و بالاتر تثبیت نمیشود. متأسفانه گزینش پذیری بین پیک های 1 و 2 با افزایش pH از 64/1 = α در0/ 2 =pH به 05/1 در 5/5 =pH کاهش می یابد، بنابراین جداسازی این پیک ها با افزایش pH بدتر می شود.
Ph فاز متحرک و Robustness
بسیاری از آزمایشگاه های دارویی دستورالعمل های کیفیت با طراحی (QbD) (3) را از کنفرانس بین المللی هماهنگ سازی (ICH) اتخاذ می کنند. این دستورالعمل ها ایجاد یک فضای طراحی را تشویق می کند که تنظیمات مختلفی را در بر می گیرد و کیفیت قابل قبولی را ارائه می دهد. از نقطه نظر کروماتوگرافی، این به معنای شناسایی محدوده ای است که یک متغیر کروماتوگرافی را می توان تغییر داد و همچنان نتایج تحلیلی قابل قبولی ارائه کرد. در متن کنونی، این به معنای انجام آزمایشهایی Robust می باشد برای تعیین اینکه چه اندازه میتوان میزان pH فاز متحرک را تغییر داد و همچنان جداسازی خوب و کافی را بدست آورد.
نمونه ای از روشی با استحکام ضعیف نسبت به pH در کروماتوگرام های شکل 4 برای نمونه ای از اسیدهای صفراوی نشان داده شده است (4). در شکل a4، تمام پیک ها در pH فاز متحرک 1/5 به خط پایه جدا شده اند. با این حال، هنگامی که PH به 2/5 تغییر می کند (شکل b4)، دو پیک آخر در همدیگر ادغام می شوند. هنگامی که از pH متر برای اندازه گیری pH محلول در طول تنظیم pH استفاده می شود، تغییرات آزمایشگاهی نرمال معمولاً 005/0 تا1/0 ± واحد pH است. هنگامی که PH یک بافر توسط تیتراسیون تنظیم می شود، تفاوت هایی مانند آنچه بین شکل هایa 4 و b 4 مشاهده می شود، زمانی که دسته های مختلف بافر تهیه می شوند، تعجب آور نخواهد بود. در نتیجه، اگر مقدار pH فاز متحرک 1/5 تعیین شود، جداسازی به اندازه کافی قوی نخواهد بود.
 شکل 4: جداسازی های شبیه سازی شده نمونه ای از اسیدهای صفراوی بر اساس داده های (مرجع 3). pH فاز متحرک: (a) 1/5، (b) 2/5
شکل 4: جداسازی های شبیه سازی شده نمونه ای از اسیدهای صفراوی بر اساس داده های (مرجع 3). pH فاز متحرک: (a) 1/5، (b) 2/5
بیایید نحوه ایجاد شرایط جداسازی رضایت بخش برای نمونه شکل 3 که Robustness قابل قبولی دارد را در نظر بگیریم. به طور کلی، ما دوست داریم فاکتورهای Retention ایزوکراتیکی، k، را 2-10 داشته باشیم، اما اگر 2-10 امکان پذیر نباشد، معمولاً 1-20 قابل قبول است. همچنین، اجازه دهید مشخص کنیم که Resolution بین پیک ها را نیز می خواهیم. علاوه بر این، ما روشی را می خواهیم که تا آنجا که ممکن است تغییرات pH را تحمل کند.
جداسازی در 0/2= pH در شکل a2 خوب به نظر می رسد، اما مقادیر k برای دو پیک اول 1< است، بنابراین خطر تداخل در زمان مرده ستون، t0، زمانی که نمونه های واقعی آنالیز می شوند، وجود دارد. در 5/ 2 = pH (شکل b 2 )، k برای اولین پیک 1~ است، و جداسازی زیادی مشاهده می شود، بنابراین این pH قابل قبول است. در 0/3= pH (شکل c2)، پیک 2 تا حدی از پیک 3 عبور کرده است و جداسازی کافی نیست. در 75/ 2 pH= (کروماتوگرام نشان داده نشده است)، پیک 3 فقط پس از پیک 2 از خط پایه Baseline جدا می شود، بنابراین این حداکثر pH قابل قبول است. در تمام مقادیر بزرگتر pH، ادغام پیکها مشاهده می شود.
با تفکیک قابل قبولی که در محدوده 0/2 ≤ ≤ pH 75/2 مشاهده می شود، احتمالاً pH پیش فرض را در میانه این نقاط تنظیم می کنیم – به عنوان مثال، 35/2 pH =. در طول آنالیز میتوانیم آزمایشها را در pH 05/2 و 65/2 انجام دهیم. اگر این شرایط، جداسازی رضایتبخشی را فراهم آورد، میتوانیم pH روش را 35/2 تعریف می کنیم و اجازه تنظیم pH را تا 3/0 ± واحد pH میدهیم. چنین رویکردی در روش به تحلیلگر اجازه می دهد تا pH را تا 3/0 واحد pH تنظیم کند و به تناسب سیستم برسد.
برای اطمینان از پایداری فاز متحرک تا حد امکان، از بافر در فاز متحرک استفاده می کنیم. بافرها 1± واحد pH از مقادیر pKa خود مؤثرتر هستند. فسفات دارای سه مقدار pKa در 1/2، 2/7 و 3/12 است، بنابراین بافر مناسبی برای استفاده در محدوده pH 3/0 ± 35/2 خواهد بود. این را با استات مقایسه کنید، با pKa 8/4 ، که بافر مناسبی برای نمونه شکل 3 نخواهد بود. از طرف دیگر، اگر لازم بود روش شکل 4 در pH 1/5 اجرا شود، بافر استات مناسب خواهد بود. نه فسفات. غلظت بافر 20 تا 30 میلیمولار برای اکثر روشهای LC رایج است، اگرچه غلظتهای کمتر از 5 تا 10 میلیمولار برای ستونهای سیلیکا با خلوص بالا مناسب است.
خلاصه
pH فاز متحرک تأثیر کمی بر Retention ترکیبات خنثی خواهد داشت، اما اگر ترکیبات قابل یونیزاسیون در نمونه وجود داشته باشد، کنترل pH برای تثبیت Retention ضروری است. pH فاز متحرک میتواند ابزار بسیار قدرتمندی برای جابجایی پیکها در کروماتوگرام در طول انتخاب و اعمال روش آنالیزی باشد، اما طرف دیگر ماجرا این است که برای حفظ شرایط جداسازی قوی، pH می بایست در طول آنالیز به دقت کنترل شود. هنگام انتخاب بافر برای کنترل pH فاز متحرک، مطمئن شوید که یک بافر با مقدار pKa در محدوده 1 واحد pH در اطراف pH مورد نظر انتخاب کنید، در غیر این صورت ممکن است بافر ظرفیت کافی برای تثبیت Retention را نداشته باشد.
References
- A. Lewis, D.C. Lommen, W.D. Raddatz, J.W. Dolan, L.R. Snyder, and I. Molnar, J. Chromatogr. A592, 183–195 (1992).
- http://sites.chem.colostate.edu/diverdi/all_courses/CRC%20 reference%20data/dissociation%20constants%20of% 20organic%20acids%20and%20bases.pdf.
- International Conference on Harmonization, ICH Q2(R2) Pharmaceutical Development (ICH, Geneva, Switzerland, 2009).
- S. Lu, J. Vialle, H. Tralongo, and R. Longeray, J. Chromatogr. A268, 1¬18 (1983).
آدرس سایت : https://www.chromatographyonline.com/view/back-basics-role-ph-retention-and-selectivity
